公司研发工作进展情况(截至2025年8月)
一、医药工业
1、研发总体情况
公司秉承“以科研为基础、以患者为中心”的企业理念,深耕内分泌、自身免疫及肿瘤等治疗领域,持续加大研发投入,不断丰富创新药研发管线布局,强化创新研发生态圈和技术平台建设,积极推进临床试验工作进度,取得了多项重大阶段性成果。截至2025年8月,公司创新药研发中心正在推进80余项创新药管线研发。2025年上半年公司医药工业研发投入(不含股权投资)14.84亿元,同比增长33.75%,其中直接研发支出11.74亿元,同比增长54.21%,直接研发支出占医药工业营收比例为15.97%。
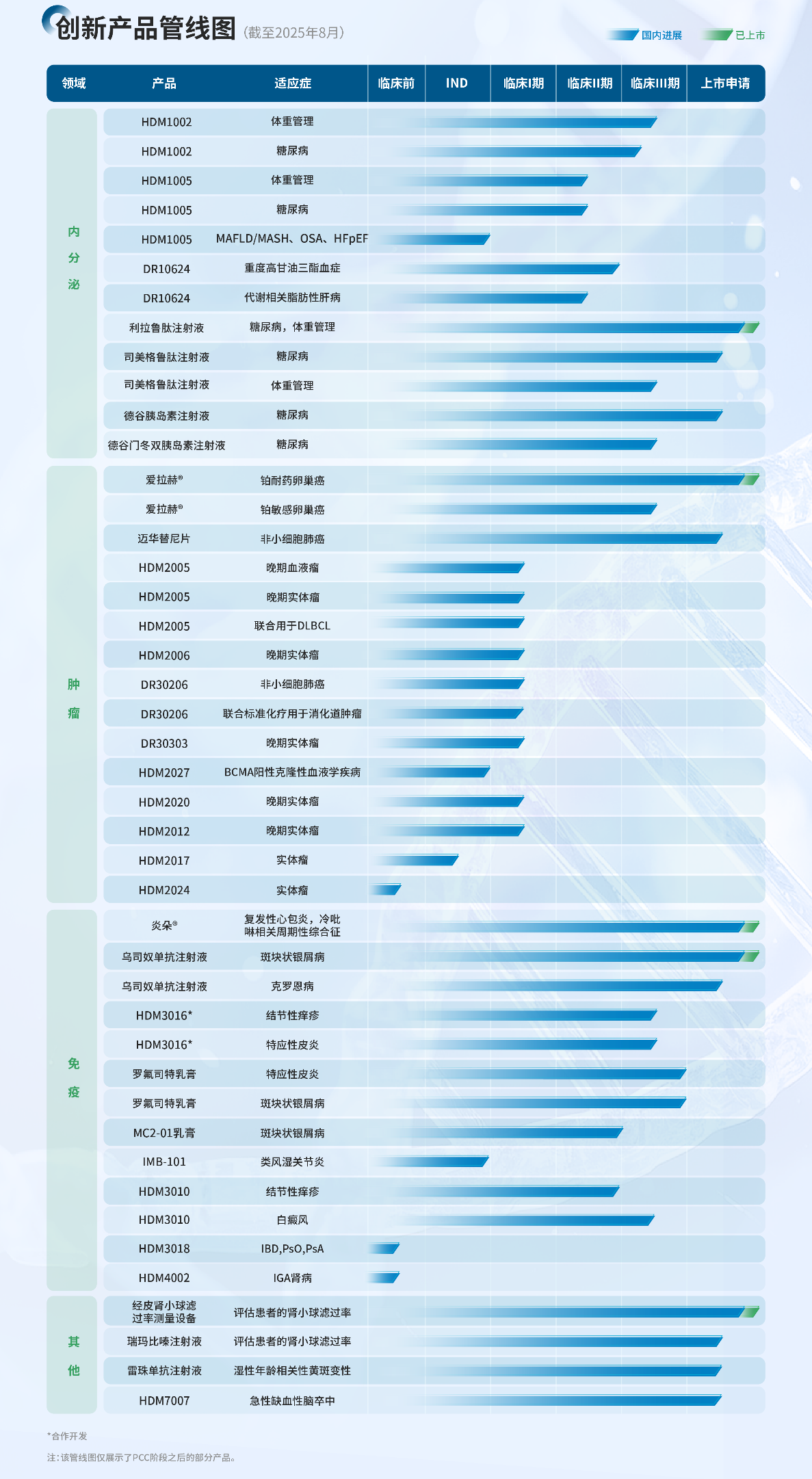
图:截至2025年8月,主要创新产品管线图
2、重要研发进展
肿瘤领域
索米妥昔单抗注射液(爱拉赫®,研发代码:IMGN853、HDM2002)由附条件批准转为常规批准的补充申请于2025年3月获得受理。
公司1类新药迈华替尼片用于EGFR 21号外显子L858R置换突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者的一线治疗的上市申请,已于2025年6月完成补充资料递交,目前处于审评阶段。
公司自主研发的差异化创新靶点ADC药物管线已形成梯度化布局,当前重点推进项目包括HDM2005、HDM2020、HDM2012、HDM2017及HDM2024。其中,靶向ROR1的ADC项目HDM2005,其联合利妥昔单抗、环磷酰胺、多柔比星(或表柔比星)和泼尼松(R-CHP)治疗既往未经系统性治疗的弥漫大B细胞淋巴瘤(DLBCL)的IND申请于2025年4月获得NMPA批准。2025年2月,HDM2005的套细胞淋巴瘤(MCL)适应症获得美国FDA孤儿药资格认定。该项目进度位于ROR1 ADC全球临床研发第一梯队,目前正在国内开展三项临床试验:一项为单药用于治疗晚期血液瘤(MCL,DLBCL,经典霍奇金淋巴瘤(cHL))的Ⅰ期临床试验,已完成四个剂量爬坡,正在进行第五个剂量爬坡,并同步进入两个剂量组的扩展阶段;一项为单药用于治疗晚期实体瘤的Ⅰ期临床试验,于2025年5月完成首例受试者给药,目前在剂量爬坡中;HDM2005联合用药针对DLBCL患者的Ⅰb&Ⅱ期临床试验,目前组长单位已启动。
此外,靶向FGFR2b的HDM2020以及靶向MUC17的HDM2012已率先取得突破性进展,均已获得中国和美国的IND批准。2025年8月,HDM2012用于治疗晚期实体瘤的Ⅰ期临床试验完成首例受试者给药,为全球首个进入临床阶段的MUC17 ADC。2025年8月,HDM2020用于治疗晚期实体瘤的Ⅰ期临床试验完成首例受试者成功给药。HDM2017已于2025年7月完成中国IND递交。HDM2024正有序推进临床前研究,预计于2025年第四季度提交IND申请。
小分子抗肿瘤药物HPK-1 PROTAC(造血祖激酶1蛋白降解靶向嵌合体)HDM2006片在美国IND申请于2025年1月获得FDA批准,适应症为晚期恶性肿瘤。此外,HDM2006片目前正在中国开展用于晚期实体瘤的Ⅰ期临床研究。
控股子公司道尔生物研发的靶向PD-L1/VEGF/TGF-β的三靶点抗体融合蛋白注射用DR30206,目前同靶点全球研发进度领先,已于2025年4月完成一线非小细胞肺癌的Ⅰb期临床试验首例受试者给药。此外,DR30206联合标准化疗用于晚期或转移性消化道肿瘤患者的治疗的临床试验申请于2025年4月获得批准,目前已启动DR30206联合标准化疗的Ⅰb/Ⅱa期临床研究入组。
公司于中国大陆独家商业化的靶向CD19的自体CART候选产品IM19嵌合抗原受体T细胞注射液于2025年8月收到补充资料通知书,目前正在准备相关技术资料,有望于2026年Q1或之前获批上市。
内分泌领域
口服小分子GLP-1受体激动剂HDM1002(conveglipron),目前已完成体重管理适应症中国临床Ⅲ期研究的全部受试者入组。此前,公司已发布的体重管理适应症Ⅱ期研究结果显示,HDM1002片在减轻体重和改善代谢方面展现出良好效果,且安全性和耐受性良好。HDM1002 200mg BID组、HDM1002 400mg QD组给药12周后体重较基线变化百分比分别为-6.08%、-6.83%;敏感性分析结果显示200mg BID、400mg QD给药12周后体重较基线变化百分比分别为-7.01%、-8.46%,与主分析结果一致,且未达平台期。此外,该产品用于2型糖尿病初治患者的Ⅲ期临床研究已完成首例受试者入组,另一项糖尿病适应症Ⅲ期临床研究已获CDE同意开展。
GLP-1R/GIPR双靶点长效多肽类激动剂HDM1005(poterepatide)注射液,目前正在开展体重管理适应症Ⅱ期临床试验,已于2025年4月完成Ⅱ期全部受试者入组,预计2025年Q4进入Ⅲ期临床研究。此外,糖尿病适应症Ⅱ期临床试验已于2025年7月完成全部受试者入组。2025年上半年,HDM1005注射液新适应症IND申请先后获得NMPA批准,分别用于阻塞性睡眠呼吸暂停(OSA)合并肥胖或超重成人患者的治疗、射血分数保留心力衰竭(HFpEF)合并肥胖或超重成人患者的治疗。
控股子公司道尔生物研发的first-in-class候选产品FGF21R/GCGR/GLP-1R三靶点激动剂DR10624注射液,已成功完成重度高甘油三酯血症的Ⅱ期临床研究并获得揭盲后的阳性顶线结果。此前,道尔生物于EASL Congress 2025大会上发布的DR10624治疗肥胖合并高甘油三酯血症的新西兰Ⅰb/Ⅱa期临床研究结果显示,肝脏脂肪降低最高达89%。此外,合并肝纤维化高风险的代谢相关脂肪性肝病以及代谢合并酒精相关脂肪变性肝病的Ⅱ期临床研究,于2025年4月完成首例受试者入组。
HDM1010片(HDM1002固定比例复方口服制剂)2型糖尿病适应症的IND申请已于2025年6月获得美国FDA批准,目前已经启动临床准备工作。
司美格鲁肽注射液糖尿病适应症的上市申请已于2025年3月递交并获受理;体重管理适应症已于2025年2月完成Ⅲ期临床研究全部受试者入组,预计2025年Q4获得顶线结果。
德谷胰岛素注射液的上市申请已于2025年2月递交并获受理,已完成生产现场核查,目前处在技术审评阶段。
德谷门冬双胰岛素注射液已于2024年12月完成Ⅲ期临床全部受试者入组,预计2025年9月获得顶线结果。
自身免疫领域
公司与荃信生物合作的乌司奴单抗生物类似药HDM3001(QX001S)新增儿童斑块状银屑病适应症的补充申请于2025年3月获批。此外,用于克罗恩病的上市许可申请和补充申请已于2025年2月获得受理。
公司与荃信生物合作的创新药HDM3016(QX005N)目前正在开展结节性痒疹和特应性皮炎2个适应症的中国Ⅲ期临床,并于2025年3月完成结节性痒疹Ⅲ期研究全部受试者入组,预计2025年Q4获得顶线结果;特应性皮炎Ⅲ期研究入组已接近尾声。
公司与美国Arcutis公司合作的HDM3014(罗氟司特乳膏),用于治疗斑块状银屑病和特应性皮炎两个适应症的中国Ⅲ期临床均已获得积极顶线结果,计划于2025年Q4递交两个适应症的NDA申请。
公司自主研发的改良型新药芦可替尼凝胶(HDM3010)治疗结节性痒疹Ⅰ/Ⅱ期临床研究已完成受试者入组。此外,该产品正在开展用于治疗白癜风的Ⅲ期临床研究。
公司与MC2 Therapeutics合作开发的MC2-01乳膏,用于治疗斑块状银屑病的中国Ⅲ期临床试验申请于2025年7月获得批准。
公司自主研发的first-in-class双特异性抗体候选药物HDM3018注射液正在进行IND开发工作,预计2026年Q3前获得中国和美国的IND批件,拟开发适应症为炎症性肠病(IBD)、斑块状银屑病(PsO)及银屑病关节炎(PsA)。
公司自主研发的first-in-class双特异性抗体候选药物HDM4002注射液正在进行IND开发工作,预计2026年Q3前完成中国和美国IND申报,拟开发适应症为IGA肾病。
其他领域
创新三类医疗器械经皮肾小球滤过率测量设备于2025年2月获得NMPA批准上市,与之配合使用的瑞玛比嗪(MB-102)注射液的上市许可申请于2024年1月获得NMPA受理,预计2025年Q4获批。此外,2025年1月,MediBeacon®TGFR(包括经皮肾小球滤过率测量设备、瑞玛比嗪注射液)已获得美国FDA批准上市。
雷珠单抗注射液的上市申请已于2025年5月递交并获受理。
3、创新研发开展的其他工作
构建创新生态体系,释放源头创新动能
围绕创新转型与国际化两大战略,公司实施的全新创新药研发机制已展现出强大自主研发潜力。聚焦内分泌、自身免疫及肿瘤领域,通过靶点发现平台试点前沿靶标,同时结合人工智能药物设计(AIDD),加速差异化创新。2023年至今,已开展超过20项早期探索性项目研究并陆续孵化出同类首创(FIC)或同类最佳(BIC)的创新药项目。
加速创新转化,助推临床开发
临床研发团队以“效率优先、质量为本”为核心理念,构建覆盖临床研究设计、运营管理、生物统计分析、注册申报及药物警戒的全周期创新体系,突破差异化创新瓶颈,努力实现临床研发多元化创新的跨越发展。研发团队从临床研究、运营、生物统计、注册、药物警戒等多个维度主导和支持了超过40项临床项目。
AI技术在药物研发中的应用
针对新药研发成本高、周期长、成功率低等核心挑战,公司打造了集多项前沿技术于一体的人工智能药物设计平台。该平台融合了靶点蛋白与药物分子结构预测、高通量虚拟筛选、AI驱动的分子生成、分子对接、深度学习模型支持的结合力预测、自由能微扰(FEP)计算、ADMET属性评估及药代动力学建模等关键模块。平台的核心创新在于实现了不同功能模块间的深度耦合与动态反馈机制,配合实验数据的持续迭代优化,构建了“干-湿实验”闭环体系,显著提升了预测准确性与成药性评估效率。
目前,该平台正不断向新药研发各个阶段延伸,从靶点发现、先导化合物筛选,到临床前评估和临床开发均有所覆盖。AIDD团队以开源工具Boltz-2、ProteinMPNN等为技术基础,聚焦抗体、蛋白类药物以及抗体偶联药物(ADC)等大分子药物的智能设计与序列优化,同时探索多模态数据驱动的结构预测与构象采样新方法。团队还计划与高校及科研机构开展联合研究,共建AI驱动的靶点发现体系。在临床前与临床阶段,多个大语言模型应用也已实现落地应用,有效提升了研发运营效率与数据处理质量。公司正加速构建一个贯穿靶点识别、药物设计、临床前评估与临床开发全流程的AI驱动创新药研发体系,助力实现更高效、更智能、更低风险的药物创新模式。
博士后科研工作站
公司全资子公司中美华东于2021年2月批准设立浙江省博士后科研工作站,2022年9月备案为国家级博士后科研工作站,工作站共招收博士后23人,其中在站14人、出站9人。公司博士后工作站在站博士后结合公司发展战略和在研管线,致力于创新药物开发前沿与转化研究,并同浙江大学、中科院上海药物研究所、浙江工业大学等高校流动站联合培养。
其他创新成果
1)专利申请
公司创新药全球研发中心高度重视知识产权保护,注重药品全生命周期的知识产权管理和专利策略的制定,以提高产品综合竞争力。创新药全球研发中心成立5年来,累计提交各项创新药专利120余项,累计专利授权数量15项;其中,2025年初至今,已取得国内外授权专利5项,递交19项PCT国家专利及诸多新技术主题优先权申请,其中多个重点国际专利进入全球五十余个国家或地区进行保护。
2)学术发表
2025年至今,在肿瘤、内分泌/代谢、自免领域,创新团队已于学术会议上发表12篇海报或口头报告:GLP-1/GIP双靶点长效激动剂HDM1005 Ⅰ期临床研究结果受邀出席2025年ADA年会口头报告;司美格鲁肽Ⅲ期和HDM1002 Ⅰb期临床研究结果受邀进行2025年ADA年会POSTER交流;HDM2006、HDM2022、HDM2012、HDM2017、HDM2020临床前研究结果均入选2025年AACR年会POSTER,同时ADC管线系列产品(含HDM2020,HDM2012和HDM2017)的临床前研究结果也入选了2025 World ADC Asia年会口头报告和Poster,pan-KRAS的抗肿瘤降解剂HDM2025的临床前研究入选2025年ASCO大会POSTER;控股子公司道尔生物自主研发的全球首创(first-in-class)具有三重激动活性,同时靶向FGFRIc/KlothoB(FGF21R)、GCG受体(GCGR)和GLP-1受体(GLP-1R)的Fc融合蛋白药物DR10624的非临床及临床研究结果均入选2025年EASL大会墙报Poster,其中临床研究结果入选大会Late-Breaker(最新突破研究)。
公司自主研发成果不断获得国际学术界认可,2022年至今,累计37项创新研究成果发表于权威期刊及学术会议,充分验证了公司自主创新能力的持续提升,也标志着公司创新转型战略取得系统性突破。
3)政府资助
截至目前,公司创新药全球研发中心共计获批政府立项21项,资助认定金额近7,000万元。公司于2024年获“杭州市领军型创新青年团队”,HMD1002项目临床前研究获“杭州市生物医药产业高质量发展专项”资助,HDM4002项目于2025年获得“中美华东国家企业技术中心能力建设”专项资助。此外,公司成功获批2024年“全省代谢疾病新药智创重点实验室”,2025年省重点实验室已正式开始运行。
二、国内医美产品注册及上市进度
(更多研发进展请关注“华东医药股份有限公司”&“华东医药投资者关系管理”微信公众号)





